- ニュース
- 添付文書
- 薬の臨床実感&助言集
- ▼×
指定されたページ、またはコンテンツが見つかりません。
指定されたページは削除されたか、アドレスが変更された可能性があります。The requested URL not found on this server.
本日アクセスの多いニュース
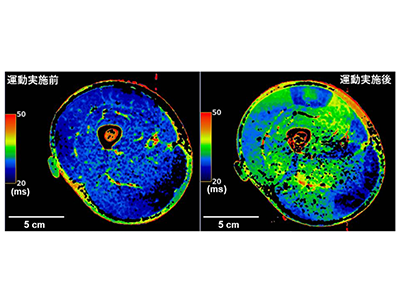 わずか「40秒」の高強度間欠的運動で、酸素消費量と大腿部の筋活動が増大-早大 posted on 4月 16, 2024
わずか「40秒」の高強度間欠的運動で、酸素消費量と大腿部の筋活動が増大-早大 posted on 4月 16, 2024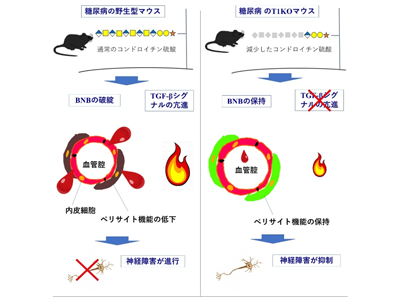 糖尿病性神経障害、発症に細胞外基質のコンドロイチン硫酸が重要と判明-新潟大ほか posted on 4月 17, 2024
糖尿病性神経障害、発症に細胞外基質のコンドロイチン硫酸が重要と判明-新潟大ほか posted on 4月 17, 2024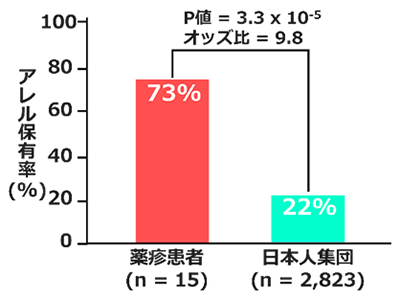 「リウマチ・潰瘍性大腸炎」治療薬の薬疹リスクアレルを発見-理研ほか posted on 4月 17, 2024
「リウマチ・潰瘍性大腸炎」治療薬の薬疹リスクアレルを発見-理研ほか posted on 4月 17, 2024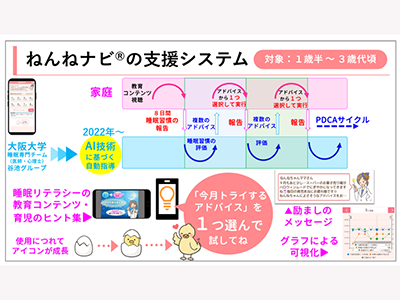 幼児の睡眠改善アドバイスアプリ「ねんねナビ」にAI追加搭載、有用性を確認-阪大ほか posted on 4月 18, 2024
幼児の睡眠改善アドバイスアプリ「ねんねナビ」にAI追加搭載、有用性を確認-阪大ほか posted on 4月 18, 2024 早期大腸がん、発がん予測につながる免疫寛容の仕組みを同定-九大ほか posted on 4月 18, 2024
早期大腸がん、発がん予測につながる免疫寛容の仕組みを同定-九大ほか posted on 4月 18, 2024
医療ニュースランキング
- 1新規胃がん発生メカニズム解明、バナナ成分を含む治療薬開発の可能性-東大病院ほか posted on 4月 15, 2024
- 2わずか「40秒」の高強度間欠的運動で、酸素消費量と大腿部の筋活動が増大-早大 posted on 4月 16, 2024
- 3「怒り」を紙に書いて捨てる・裁断すると、気持ちが鎮まることを実証-名大 posted on 4月 12, 2024
- 4高血圧発症リスクを下げる男性の食事パターン、AI解析で判明-東北大 posted on 4月 9, 2024
- 5皮膚筋炎に合併する間質性肺炎、治療標的候補としてIL-6を同定-東京医歯大ほか posted on 4月 15, 2024
- 6脊髄損傷、患者の脂肪由来幹細胞が治療に役立つ可能性、P1試験で検証-米研究 posted on 4月 11, 2024
- 7脊髄小脳失調症1型、バイオマーカーにつながる最初期の病態を解明-東京医歯大ほか posted on 4月 12, 2024
- 8【腎臓学会など調査】紅麹中止で大半回復-死亡例に既往歴あり posted on 4月 12, 2024
- 9新型コロナの次世代 mRNA ワクチン「コスタイベ筋注用」、国内第Ⅲ相試験で既存オミクロン株対応2価ワクチンに対する優越性検証を達成-Meiji Seika ファルマ posted on 4月 2, 2024
- 10住宅の種類と死亡リスクの関連を検証、低リスクは「持ち家」「公的賃貸」-千葉大ほか posted on 4月 16, 2024
医療
「心血管疾患」患者のいる家族は、うつ病リスクが増加する可能性-京大ほか
京都大学は、家族間での心血管疾患(CVD)とうつ病の関連を明らかにしたと発表した。… 続きを読む
読了:約 1分49秒
2024年04月18日 AM11:22
海外
肝細胞がんに「ペムブロリズマブ+個別化がんワクチン」が有望な可能性ーAACR 2024
標準的な免疫療法にオーダーメイドの抗腫瘍ワクチン(以下、個別化がんワクチン)を追加することで、肝細胞がんが縮小する患者の割合が、免疫療法のみを受けた場合の約2倍になることが、新たな研究で示された。… 続きを読む
読了:約 2分7秒
2024年04月18日 PM05:30
医薬品・医療機器
バビースモ、網膜色素線条P3試験で主要評価項目達成-中外
中外製薬株式会社は、バビースモ(R)(一般名:ファリシマブ)について、新生血管を伴う網膜色素線条対象の国内第3相臨床試験(NIHONBASHI試験)で主要評価項目を達成したことを発表した。… 続きを読む
読了:約 1分57秒
2024年04月17日 AM09:30
新型コロナの次世代 mRNA ワクチン「コスタイベ筋注用」、国内第Ⅲ相試験で既存オミクロン株対応2価ワクチンに対する優越性検証を達成-Meiji Seika ファルマ
読了:約1分52秒
2024年04月02日 PM04:00
テクノロジー
幼児の睡眠改善アドバイスアプリ「ねんねナビ」にAI追加搭載、有用性を確認-阪大ほか
大阪大学は、双方向性睡眠啓発アプリ「ねんねナビ(R)」の指導システムにAI技術を追加で導入し、各家庭の状態に応じたスモールステップの睡眠習慣改善のアドバイスを自動的に送るとともに、育児を労うメッセージを継続的に送って養育者をエンパワメントし、子育てに伴走する支… 続きを読む
読了:約 2分12秒
2024年04月18日 AM09:30
事件・事故
新型コロナ変異株、変異「種」は誤り-感染症学会
日本感染症学会は、英国などで出現し、感染が拡大している新型コロナウイルス変異株について、一部報道機関で統一して用いられている「変異種」という表現は学術的に誤用であるため、正しい表記をお願いしたいと報道機関に向け発信した。… 続きを読む
読了:約 1分34秒
2021年01月29日 AM11:30
行政・経営
【医療機能評価機構】輸液を末梢静脈から誤投与-「中心静脈から」周知促す
日本医療機能評価機構は15日、中心静脈から投与すべき高カロリー輸液や高濃度糖液などについて、末梢静脈から投与した事例が8件発生したことを医療安全情報で公表し、医療従事者に注意喚起を行った。… 続きを読む
読了:約 1分10秒
2024年04月17日 AM10:13








